|
|
|
Устюгов В.В.
Физические и биологические свойства воды.
До ХIХ века люди не знали, что вода химическое соединение. Считали обычным химическим элементом. А потом еще сто лет думали, что вода — это соединение с формулой Н2О. В 1932 году мир изумился: оказывается, кроме обычной, в природе существует еще и тяжелая вода, а на сегодняшний день известно уже 135 изотопных разновидностей воды.
Краткий перечень следующих основных аномальных свойств воды, которые необходимо учитывать при работе с водными растворами:
- при Т=4оС- плотность максимальна =1,0 (точнее 0,9999), а при Т = 0оС- объем увеличивается на 10% и плотность = 0,9168 (молекулы льдоподобной воды расположены таким образом, что между ними возникают большие пустые пространства и поэтому лед — рыхлообразный);
- если бы вода состояла бы из плотной упаковки молекул, то тогда плотность воды =1,84 г/см3, а в действительности плотность воды =1,0, т.е. между молекулами имеются пустоты; вода, можно сказать, обладает «запасами пространства», связанные с полостями в ее структуре; изменение этих объемов и приводит то к уплотнению, то к разрыхлению упаковки молекул, а также к изменению объемной плотности воды;
- если бы вода состояла только из одиночных молекул отстоящих друг от друга на равном расстоянии, то тогда температура ее кипения была бы = 65,5оС, но т.к. она имеет ассоциации молекул, то кипит при 100оС;
- вязкость воды тоже имеет аномалию и, в отличие от других жидкостей, она снижается при повышении давления; повышение температуры также понижает вязкость воды;
- молекулярная вода обладает небольшим дипольным моментом и слабо ионизирована; растворенное вещество остается в растворе благодаря исключительному свойству воды; сила притяжения между «+» и «-» ионами обратно пропорциональна квадрату расстояния между ними, умноженному на константу — диэлектрическую проницаемость, которая выше другого любого вещества; (чтобы сила притяжения между ионами в воде была бы такой же как, например, в воздухе, то расстояние между ионами должно быть в 9 раз меньше);
- теплоемкость: 1л на 1оС надо 1 калорию (керосин — в 2 раза меньше = 0,5к; ртуть = 0,03к); охладив 1 м3 воды на 1оС, можно нагреть на 3оС ~1000 м3 воздуха; скрытая теплота плавления: — для расплавления 1 кг льда надо затратить 79 калорий (для стали надо в 2 раза меньше, а для свинца в 15 раз меньше);
- динамическая вязкость (внутреннее трение): при Т = 0оС — динамическая вязкость чистой воды = 1,789 спз, а при Т= 100оС в 6 раз меньше = 0,282 спз; (вязкость пара водяного при 15о С = 0,98 спз);
- наименьшая теплоемкость у воды = 37,69оС, что соответствует внутренней температуре тела человека; (уникальное состояние, когда вероятность течения обратимых и необратимых биохимических реакций в живых организмах максимальна и это обеспечивает возможность управления ими);
- поверхностное натяжение воды — на поверхности могут лежать предметы в 8 раз тяжелее воды: при Т = 18оС = 72 дин/см, а спирт = 22, ацетон = 24; бензин = 29; ртуть = 500; (предельная высота подъема при 15С: в крупном песке = 2м; в мелком песке = 1,2м; в глине = 12м; причем продолжительность подъема воды в крупных капиллярах = 5 ч 10 суток, а в мелких капиллярах до 16 месяцев);
Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О). В отдельной молекуле воды ядра водорода и кислорода расположены равнобедренным треугольником со сравнительно крупным ядром кислорода на вершине и двумя мелкими ядрами водорода у основания. В молекуле воды имеются четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у ядер водорода — протонов. Такая асимметричность распределения электрических зарядов воды обладает ярко выраженными полярными свойствами, она является диполем с высоким дипольным моментом (1,87 дебай — внесистемная единица электрического дипольного момента молекул.)
Благодаря этому молекулы воды стремятся нейтрализовать электрическое поле. Под воздействием диполей воды на поверхности погруженных в нее веществ межатомные и межмолекулярные силы ослабевают в 80 раз. Столь высокая диэлектрическая проницаемость из всех известных веществ присуща только воде. Этим объясняется ее способность быть универсальным растворителем.
Разлагая молекулы на ионы (например, соли кислот), сама вода проявляет большую устойчивость. Из 1 млрд. молекул воды диссоциированными при обычной температуре оказываются лишь две, при этом протон не сохраняется в свободном состоянии, а вероятнее всего входит в состав иона гидроксония. (Гидроксоний (Н3О+) — это гидратированный ион водорода)
Вода химически не изменяется под действиями большинства тех соединений, которые она растворяет, и не изменяет их. Это характеризует ее инертным растворителем, что важно для живых организмов на нашей планете, поскольку необходимые их тканям питательные вещества поступают в водных растворах в сравнительно устойчивом виде. Как растворитель вода многократно используется, неся в своей структуре память о ранее растворенных в ней веществах.
Молекулы в объеме воды сближаются противоположными зарядами, возникают межмолекулярные водородные связи между ядрами водорода и не поделенными электронами кислорода, насыщая электронную недостаточность водорода одной молекулы воды и фиксируя его по отношению к кислороду другой молекулы. Тетраэдрическая направленность водородного облака позволяет образовать четыре водородные связи для каждой водной молекулы, которая благодаря этому может ассоциировать с четырьмя соседними.
Микро молекулярная структура воды с большим количеством полостей позволяет ей, разрывая водородные связи, присоединять молекулы или части молекул других веществ, способствуя их растворению...
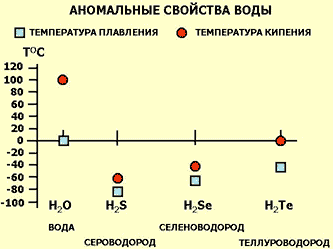
Сравнивая воду — гидрид кислорода с гидридами элементов, входящих в одну с кислородом подгруппу периодической системы Д.И. Менделеева, следовало бы ожидать, что вода должна кипеть при — 70оС, а замерзать при — 90оС. Но в обычных условиях вода замерзает при 0оС и закипает при 100оС.
Такое резкое отклонение от установленной закономерности как раз и объясняется тем, что вода является ассоциированной жидкостью. Ассоциированность ее сказывается и на очень высокой теплоте парообразования. Так, для того чтобы испарить 1 г воды, нагретой до 100оС, требуется в шесть раз больше тепла, чем для нагрева такого же количества воды от 0 до 80оС. Благодаря этому вода является мощнейшим энергоносителем на нашей планете. По сравнению с другими веществами, она способна воспринимать гораздо больше тепла, существенно не нагреваясь. Вода выступает как бы регулятором температуры, сглаживая благодаря своей большой теплоемкости резкие температурные колебания. В интервале от 0 до 37оС теплоемкость ее падает и только после 37оС начинает повышаться. Минимум теплоемкости воды соответствует температуре 36 — 39оС — нормальной температуре человеческого тела. Благодаря этому возможна жизнь теплокровных животных, в том числе и человека.
При температуре 35-42°С (пределы температур человеческого тела) достигается уникальное состояние, когда массы квазикристаллической и жидкой воды равны друг другу. Здесь способность одной структуры переходить в другую, – их вариабельность, – максимальна. Это замечательное свойство предопределяет равную вероятность течения обратимых и необратимых биохимических реакций в живых организмах и обеспечивает возможность управления ими. Физике биологических структур известно, что на поверхности клеток и биомолекул обычная вода превращается в воду необыкновенную: она уже не подчиняется законам физики, все ее свойства меняются.
Диэлектрическая проницаемость, например, уменьшается в 10 раз, а тепло-проводимостъ увеличивается в 70 раз. На поверхности биологических образований молекулы Н2О претерпевают структурно-ориентационную упорядоченность, образуя так называемую клатратную пленку, которая представляет собой кристаллогидрат со строго ориентированными дипольными моментами молекул воды. Толщина этой кристаллогидратной пленки составляет всего от 3 до 12 ангстрем. Оказалось, что необходимым условием и первоосновой нормальной жизни клеток является этот клатратный слой. И уже на расстоянии 12-13 ангстрем, т.е. чуть далее 4-5 слоев молекул Н2О, их ориентация, например, фосфолипидной поверхностью не проявляется: на этих расстояниях вода ничем не отличается от обычной воды. Оказалось, что в самой клатратной пленке, расположенной, например, на поверхности клеточной мембраны, обменные процессы между молекулами воды осуществляются с частотой 10000 в секунду, в то время как с окружающей объемной водой молекулы Н2О меняются местами с частотой на два порядка меньше. Это приводит к тому, что растворенным в воде примесям термодинамически не выгодно находиться в клатратных слоях воды, поэтому они предпочитают не клатратную, а объемную воду. Таким образом, будучи связанными с живой материей и защищая ее, клатраты сами защищены незримым барьером от разрушающего действия на них объемной воды клетки вместе с растворенными в ней вредными, ядовитыми и генотоксичными веществами. И чем толще и прочнее клатратный слой, тем более благоприятны и стабильны термодинамические и биологические условия жизнедеятельности, как отдельной живой клетки, так и всего организма. Поэтому всякое загрязнение и ухудшение структуры объемной воды внутри живого организма отрицательно и пагубно влияет на кристаллогидратные образования, ухудшая жизнедеятельность клетки, конформационные переходы спиральных структур ДНК и других биологических молекул и, в конечном итоге, – на генофонд человека. Лишь чистая структурированная вода оптимизирует функции генов – этой основы здоровья и долголетия человека
Существует теория: о существовании микрофазовых превращений в системе «жидкость-кристалл », т. е. « вода-лед» (Л.А. Кульский, В.О. Даль). При изменении температуры от 0 до 100оС в нормальных условиях вода последовательно проходит пять фазовых состояний. Температурными границами существования фаз служат величины 0; 15; 30; 45; 60 и 100оС, причем первая фаза характеризуется гексагональной кристаллической структурой, а остальные четыре — кубической. Границы третьей фазы (30-45оС) очерчивают температурную область жизни теплокровных животных.
Вода при охлаждении в нормальных условиях ниже 0оС кристаллизируется, образуя лед, плотность которого меньше, а объем почти на 10% больше объема исходной воды. Охлаждаясь, вода ведет себя как многие другие соединения: понемногу уплотняется-уменьшает свой удельный объем. Но при 4оС (точнее, при 3,98оС) наступает кризисное состояние: при дальнейшем понижении температуры объем воды уже не уменьшается, а увеличивается. С этого момента начинается упорядочение взаимного расположения молекул, складывается характерная для льда гексагональная кристаллическая структура. Каждая молекула в структуре льда соединена водородными связями с четырьмя другими. Это приводит к тому, что в фазе льда образуется ажурная конструкция с « каналами» между фиксированными молекулами воды. В водных растворах некоторых органических веществ вокруг молекул примесей возникают упорядоченные группы водных молекул — своеобразные зоны «жидкого льда», имеющие кубическую структуру, которая отличается большой рыхлостью по сравнению с гексагональной. Появление такого льда вызывает значительное расширение всей замерзшей массы. При появлении льда разрушаются связи не только дальнего, но и ближнего порядка. Так, при 0оС 9 — 15% молекул Н2О утрачивают связи с соединениями, в результате увеличивается подвижность части молекул и они погружаются в те полости, которыми богата ажурная структура льда. Этим объясняется сжатие льда при таянии и большая по сравнению с ним плотность образующейся воды. При переходе « лед-вода» плотность возрастает примерно на 10%, и можно считать, что эта величина определенным образом характеризует количество молекул Н2О, попавших в полости.
Тяжелая вода D2O по своим свойствам несколько отличается от обычной: кипит она при температуре 101,42єC, замерзает – при 3,8єС. Солей в ней растворяется в среднем на 10% меньше, чем в Н2O, плотность ее выше на 10%, а вязкость – на 23%, чем в обычной воде. По сравнению с обычной, тяжелая вода испаряется менее интенсивно, поэтому в замкнутых водоемах отмечается ее повышенное содержание. Количество тяжелой воды пополняется при выпадении атмосферных осадков, из паровой фазы раньше, чем протиевая. D2O угнетает жизнедеятельность высших организмов. Замедляется скорость их роста, интенсифицируются процессы старения.
Вода для питья должна быть чистой, структурированной, с пониженным содержанием дейтерия. Льды и воды ледового материка отличаются самым низким содержанием дейтерия на планете. Вследствие особенностей естественного процесса круговорота воды к наиболее легким относятся также воды центральных районов Азии и Юго-Западного Тибета, а, кроме того, льды Гренландии. В ледниковой и снеговой воде высоких широт концентрация дейтерия часто на 20-25% ниже, чем в воде равнинных рек. Талая вода имеет повышенную структурированность и пониженное содержание дейтерия и трития.
Выше 0оС молекулы воды вследствие теплового возмущения утрачивают способность образовывать постоянную жесткую решетку, но тенденция к упорядочению сохраняется. Вода находится в состоянии, которое условно характеризуют как «квазикристаллическое». При той температуре, когда лед превращается в воду, сохраняются еще многие водородные связи, и в воде присутствуют ассоциаты молекул с открытой тетраэдрической структурой. Повышение температуры вызывает распад этих пространственных ассоциатов, что приводит к дальнейшему увеличению плотности воды — до температуры 4оС. При дальнейшем росте температуры закономерное расширение воды, обуславливаемое усилением молекулярного движения, превосходит эффект структурной перестройки « лед-вода», и плотность воды плавно снижается. Благодаря особенностям переходов «лед-вода», осуществляющихся в интервале О — 4оС, при сезонных изменениях температуры реки и озера не промерзают до дна. Верхний слой, охладившись до 4оС и достигнув максимальной плотности, опускается на дно водоема, принося кислород его обитателям и обеспечивая равномерное распределение питательных веществ. Поднявшиеся к поверхности более теплые слои воды уплотняются при соприкосновении с приповерхностным воздухом, охлаждаются до 4оС и в свою очередь опускаются. Такое «перемешивание» происходит до тех пор, пока циркуляция естественно не прекращается и водоем не покроется плавающим слоем льда. Теплопроводность льда намного меньше, чем воды, поэтому он надежно предохраняет глубины водоема от сквозного промерзания.
Из 36 стабильных и радиоактивных разновидностей молекул воды наиболее распространены 9 стабильных изотопов. Изотопы водорода — дейтерий, тритий и протий. В норме в обычной воде находится 0,015 атомных процентов дейтерия, в талой воде немного ниже. Известны легкая, тяжелая и сверхтяжелая вода в зависимости от содержания в ней этих изотопов. Диаметр молекулы воды — около 2,8 ангстрем. Каждая молекула может соединиться с четырьмя другими. Но это происходит только в твердом состоянии — во льду. При температуре 37оС время оседлости воды – 10 — 11сек., а во льду 10 — 5 сек. Чем меньше движется молекула воды, чем ближе ее свойства к свойствам воды в состоянии льда, тем выше с точки зрения биологии качество воды. Энтропия — мера хаоса любой системы. У воды в состоянии льда энтропия меньше всего.
Многие биологические свойства воды определяются ее структурой, то есть соотношением мономерных и ассоциированных молекул воды в жидком состоянии. Согласно одной из моделей — кластерной — в жидкой воде, наряду с мономерными молекулами, имеются ассоциаты, кластеры молекулы воды. Рой молекул воды, объединенных водородными связями (их называют кластерами), со временем жизни 10-10 — 10 -11 сек. находятся в жидкой массе мономерных молекул. Они разрушаются и воссоздаются вновь, поэтому данная модель называется моделью «мерцающих скоплений». Объединение прочих кластеров является основой длительной структурной памяти воды, а быстро распадающихся — кратковременной. Содержащиеся в воде токсические соединения после удаления так изменяют ее структуру, что она оказывает повреждающее воздействие. Серьезным доказательством существования памяти воды является гомеопатия. Лечебное воздействие гомеопатических лекарств основывается на том следе, который они оставляют в структурной памяти воды.
Среди необычных свойств воды следует отметить и ее исключительно высокое поверхностное натяжение — 72, 7 эрг/см2 (при 20оС). В этом отношении среди жидкостей вода уступает только ртути. Поверхностное натяжение проявляется в смачивании. Все вещества, которые легко смачиваются водой, имеют в своем составе молекулы с атомами кислорода. Энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовывать дополнительные водородные связи с этими атомами кислорода, что и обуславливает эффект смачивания. Смачивание и поверхностное натяжение лежат в основе явления, названного капиллярностью. Оно состоит в том, что в узких каналах вода способна подниматься на высоту гораздо большую, чем та, которая допускается силой тяжести для столбика данного сечения. Капиллярность имеет огромное значение для эволюции жизни на нашей планете. Благодаря этому явлению вода смачивает толщу земли, лежащую значительно выше грунтовых вод, и доставляет корням растений растворы питательных солей с глубины в десятки метров. Капиллярностью во многом обусловлено движение крови и тканевых жидкостей.
Память воды
Особенно наглядно изменчивость воды продемонстрировал японский исследователь Масару Эмото — выпускник университета в Иокогаме и доктор наук по проблемам альтернативной медицины в двух томах своей книги «Послания воды». Доктор Эмото провел исследования, в ходе которых он замораживал капельку воды, а потом — при температуре -5 градусов — рассматривал образовавшиеся кристаллы под микроскопом и фотографировал их встроенной в микроскоп фотокамерой. Подвергая воду различным воздействиям, он снова ее замораживал, фотографировал и сравнивал изменения.
| СТРУКТУРА ВОДЫ | ||||
| Дисциллят | Лёд Антарктиды | Вода озера в Японии | ||
|
||||
Наиболее рельефно эти изменения видны после того, как вода «прослушивает» музыку. Самые красивые кристаллы образуются под воздействием классики. Менее эффектные, но тоже гармоничные дает народная музыка. И уж совсем безобразная «грязь» остается от музыки в стиле «тяжелого металла».
| ВЛИЯНИЕ МУЗЫКИ НА СТРУКТУРУ ВОДЫ | |||||||||
| Вода из реки | Бетховен | Heavy Metal | Танец KAWACHI | Бах | Тибетская сутра | ||||
|
|
||||||||
| Влияние молитвы на структуру воды из реки |
|||
| 1-перед молитвой |
2-после молитвы |
||
|
|||
Оказалось, что молекулярную структуру воды меняют вибрации человеческой энергии, мыслей слов, идей и звуков.
| Изменение структуры воды под действием мысли - надписи на листочке, приложенном к колбе с водой |
||||
| «Спасибо» | «Я тебя убью» |
«Адольф Гитлер» |
||
|
||||
Необходимо принять во внимание то, что вода после воздействия замораживается в кристаллы льда, но как меняется физическая структура льда! Это заставляет нас подумать и представить, что то же самое происходит и с водой внутри нашего организма!
Московские ученые повторили опыты Масару Эмото, которые можно наглядно видеть на фотографиях, полученных под микроскопом при 2000-кратном увеличении. На воду воздействовали аквадиском – срезом с торца бревна от дерева, выросшего в экологически чистом районе, используя его как пассивный переизлучатель под сосудом с водой.
Посмотрите на эти фотографии: спутать родниковую воду с водопроводной невозможно!
 |
 |
 |
 |
 |
|
1.Родник Сергия Радонежского (г. Радонеж) |
2. Водопроводная вода |
3.Водопроводная вода (после Аквадиска) |
4.Вода, прошедшая мембранную очистку. |
5. Вода после мембранной очистки (после Аквадиска) |
 |
 |
 |
 |
 |
|
6. Родник Тропарево, г.Москва |
7.Деионизированная вода |
8. Дистиллированная вода |
9. Бутилированная вода |
10. Бутилированная вода (после Аквадиска) |
Наши отечественные ученые проводили исследования со святой водой. Оказалось, что она и в самом деле долго не портится и ею можно исцелять различные заболевания, самые тяжелые — с помощью святой «трехзвонной» воды. Ее берут в трех разных храмах, отстоящих друг от друга настолько, что бы колокольный звон одной церкви не был слышен в другой, а потом воду сливают вместе. Такая вода обладает удивительной восстановительной программой. И при ее исследовании были получены сенсационные результаты.
В лаборатории доктора технических наук профессора Павла Госькова поставили интересный эксперимент. Святую воду доливали в сосуды разной емкости, наполненные обычной водопроводной водой. И хотя соотношение было 10 граммов святой воды и 60 литров водопроводной, следующий анализ показал, что простая вода целиком превращалась в святую — по своей структуре и биологическим свойствам. Значит, объяснима и гомеопатия.
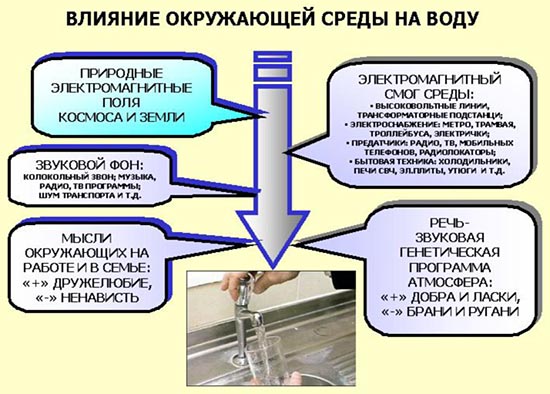
Когда мы наливаем воду в стакан, не забывайте, как окружающая среда влияет на нее. (см. рис.)
Это краткий перечень свойств воды, которую мы пьем, готовим на ней пищу, в ней мы плаваем в бассейнах, стираем и производим массу продукции в различных отраслях промышленности: выделываем кожу и меха, поливаем растения, обогащаем сырье на обогатительных предприятиях, и т.д. и т.п.
Устюгов В.В. Факторы, определяющие качество жизни, или почему мы не бессмертны. Природная вода // «Академия Тринитаризма», М.,
|
|




