|
|
|
Татьяна Романовская
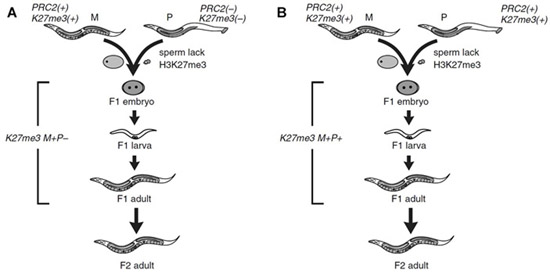
Рис. 1. Схема экспериментов по скрещиванию червей Caenorhabditis elegans. M — самки, P — самцы. A — экспериментальное скрещивание нормальных гавайских самок с британскими самцами, у которых был выключен комплекс PRC2. B — контрольное скрещивание нормальных гавайских самок с нормальными британскими самцами. Рисунок из обсуждаемой статьи в Nature Communications
Эпигенетическое наследование — наследование приобретенных признаков, то есть фенотипических изменений, которые обусловлены не мутациями генов, а изменением их активности, — предмет горячих дебатов среди биологов. К настоящему времени имеется внушительное число описанных случаев такого типа наследования у самых разных организмов — как животных, так и растительных. На этот раз ученые из США, проделав изящный эксперимент с нематодами Caenorhabditis elegans, отследили не только явление, но и сам механизм до мельчайших молекулярных деталей, доказав, что активность генов может наследоваться благодаря связанным с ДНК молекулам модифицированных гистонов. Теперь нужно убедиться, что сделанные выводы справедливы и для других организмов (скажем, для человека).
Как известно, вопросы наследственности — способности живых организмов передавать те или иные признаки своим потомкам — исследуются в рамках генетики: признаки определяются белками, а белки кодируются генами. Кодирование белков подразумевает, что сначала на ДНК в результате транскрипции образуется молекула РНК, а потом на РНК в результате трансляции образуется белок. Особи одного вида имеют небольшие различия в последовательностях молекулы ДНК, которые передаются детенышам от родителей, предопределяя то, какими будут гены, белки и признаки у следующего поколения.
Но признаки конкретного организма зависят не только от его генов, но и от того, насколько активно эти гены экспрессируются. То есть от того, какое количество молекул РНК и белков производится благодаря работе генов в единицу времени. Активность экспрессии генов регулируется в клетках эукариот при помощи специальных молекулярных механизмов, изучением которых сейчас преимущественно занимается эпигенетика. Две наиболее изученных группы таких механизмов — метилирование ДНК (присоединение метильной группы к цитозину) и разнообразные химические модификации гистонов (белков, обеспечивающих упаковку ДНК внутри клеточного ядра), которые либо уплотняют упаковку ДНК (и тогда активность экспрессии генов снижается), либо, наоборот, делают упаковку менее плотной (что способствует повышению экспрессии генов).
Эпигенетика выделилась в самостоятельный раздел биологической науки совсем недавно, уже в XXI веке, а основной предмет ее изучения — наследуемые фенотипические изменения, не связанные с изменением нуклеотидной последовательности в геноме. Таким образом, явление эпигенетического наследования составляет, в общем-то, центральную проблему данной научной области. А ведь еще в XX веке говорить о наследовании приобретенных признаков было просто крамолой.
Справедливости ради заметим, что проблема на самом деле распадается на две части. Один вопрос — когда речь идет об эпигенетическом наследовании в ряду митотических делений соматических клеток. Именно это позволяет стволовым клеткам разных типов (крови, эпидермиса, печени и т. д.) по ходу делений «не забывать», какими свойствами они должны обладать для выполнения своей особенной функции в организме. Этот аспект, связанный с реализацией программы дифференцировки клеток в процессе роста организма, известен достаточно давно и не вызывает особых проблем и разногласий. Совсем другая история, когда речь заходит о возможности передачи «приобретенных признаков» от родителей к потомкам при половом размножении. Традиционно считалось, что это принципиально невозможно, ведь передаются только гены как последовательности, а установление особенностей их работы каждый раз начинается с чистого листа, определяясь тем, что воздействует непосредственно на данную особь, но не на ее родителей.
Но действительность неумолима: снова и снова у разных организмов обнаруживаются факты того самого «запрещенного» наследования «приобретенных признаков», которые уже невозможно просто игнорировать, а приходится искать им разумные объяснения. «Элементы» уже не раз рассказывали об исследованиях на эту тему (см., например, Наследственная информация записана не только в ДНК, «Элементы», 01.06.2006 и Пищевое поведение у пещерной рыбы наследуется эпигенетически, «Элементы», 27.09.2012).
Сейчас мы рассмотрим еще одну работу, выполненную учеными из Калифорнийского университета в Санта-Крузе под руководством Сьюзан Строум (Susan Strome), в которой было использовано очень изящное решение, позволившее в очередной раз подтвердить и максимально дотошно изучить все тончайшие аспекты эпигенетического наследования у нематод Caenorhabditis elegans — любимых модельных животных у биологов. C. elegans относится к классу круглых червей, размер взрослой особи составляет всего около 1 мм, а весь жизненный цикл длится всего 4 дня. В лабораториях этих нематод содержат в обычных чашках Петри.
Эта исследовательская группа уже длительное время изучает молекулярные особенности наследования у нематод, так что обсуждаемая работа — очередная в целой серии их публикаций на эту тему. В частности, ранее эта группа выяснила, что хромосомы сперматозоидов у нематод содержат в своем составе довольно много гистонов, в отличие, к примеру, от мышей и прочих млекопитающих, у которых почти все гистоны в хромосомах сперматозоидов заменяются на другие белки — протамины. Так могут ли гистоны, связанные с ДНК сперматозоидов у червей-отцов, переносить в зиготу свои модификации и предопределять поведение генов в клетках потомков, влияя на их фенотипические признаки?
Работали с двумя линиями нематод. Одна линия родом из Великобритании, другая — с Гавайских островов. Генетически эти линии довольно далеки друг от друга, что имело особый смысл в дизайне эксперимента, как будет видно из дальнейшего рассказа.
В прошлых экспериментах ученые заметили, что на хромосомах сперматозоидов у С. elegans присутствуют гистоны H3, меченые метильными группами по остатку лизина в положении 27, — далее эта модификация будет обозначаться как К27mе3 (T. Tabuchi et al., 2018. Caenorhabditis elegans sperm carry a histone-based epigenetic memory of both spermatogenesis and oogenesis). Эта метка поддерживается постоянно на хромосомах по мере их дупликации благодаря довешиванию таких же меток при помощи особого белкового комплекса, именуемого коротко PRC2. Если сломать работу белков этого комплекса в клетках-предшественниках сперматозоидов, то хромосомы оказываются полностью лишены этой метки, что и было нужно исследователям. Известно, что присутствие метки К27mе3 в гистоне H3 сопровождается уплотнением хроматина и снижением активности экспрессии генов в соответствующих участках хромосом.
Итак, были проведены два скрещивания нематод из разных линий. В каждом из которых самки-мамы были гавайскими, а самцы-папы — британцами. В контрольном скрещивании самцы были обычными, а в опыте у них был сломан PRC2. У самок в обоих скрещиваниях PRC2 был рабочим и хромосомы содержали метки K27me3. От этих скрещиваний получали потомство первого и второго поколения. В зиготе при скрещивании половина хромосом была от мамы, а половина от папы. Состояние хромосом при этом получалось либо K27me3 M+P+ (метилированные гистоны содержатся в хромосомах обоих родителей), либо K27me3 M+P− (метилированые гистоны отсутствуют в хромосомах, полученных от отца).
Еще одна хитрость заключалась в том, что использованные линии червей отличаются от природных отсутствием у них метилирования ДНК — это позволило исключить из рассматриваемых механизмов эпигенетического наследования данный тип модификации.
Схема проведенных экспериментов показана на рис. 1.
Далее нужно было отследить, что будет происходить с гистонами на хромосомах отцовского происхождения по мере роста и развития потомков, как эти изменения отразятся на работе генов и как все это в конечном итоге отразится на фенотипе. Чтобы за половинами генома было легче следить по отдельности, использовали самок с особой мутацией, которая приводит к тому, что на протяжении первых нескольких клеточных делений эмбриона после оплодотворения каждый геном (материнский и отцовский) остается изолирован в собственном ядре. Ученые брали двухклеточные и восьмиклеточные эмбрионы (рис. 2) и проводили двойное окрашивание: во-первых, красителем для ДНК (на фотографиях он дает красный цвет), а во-вторых, мечеными флуоресцентной меткой антителами к гистону с меткой K27me3 (на фотографиях эти метки дают зеленый цвет). Как видно из рис. 2, на двухклеточной стадии у гибридов K27me3 M+P− в клетках присутствуют два ядра разного цвета: одно зеленое — с метилированными гистонами (от матери), другое красное — без метилирования (от отца).
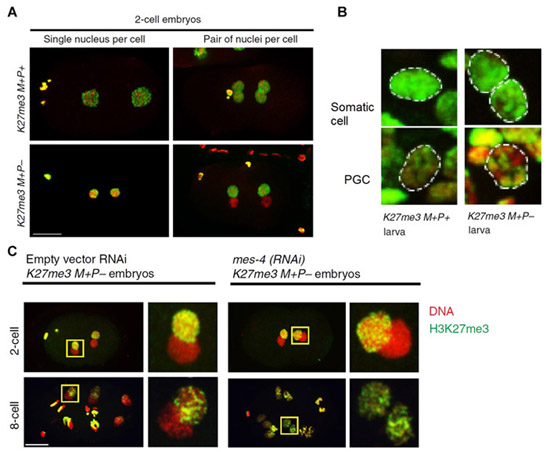
Рис. 2. Анализ распределения меток K27me3 в ядрах клеток у потомков F1 от проведенных скрещиваний. A — окрашивание ядер клеток у эмбрионов, полученных от двух вариантов скрещиваний. B — окрашивание ядер соматических клеток (Somatic cell) и клеток-предшественников гамет (PGC) у личинок. C — результаты эксперимента без выключения (слева) или с выключением (справа) гена mes-4: видно, что в первом случае дифференциальная окраска ядер сохраняется у восьмиклеточного эмбриона, а во втором случае ядра от обоих родителей к этой стадии становятся одинаковыми. Рисунок из обсуждаемой статьи в Nature Communications
Аналогичным образом проводили окрашивание клеток, взятых из личинок. Оказалось, что в соматических клетках индивидуальное маркирование материнского и отцовского геномов утрачивалось, а вот в клетках-предшественниках половых клеток (PGC) оно сохранялось, причем — и у взрослых особей тоже, приводя к изменениям в физиологии потомства второго поколения, о чем будет сказано чуть дальше.
Ученые выяснили, что поддержание неметилированного состояния генома, полученного из сперматозоидов зависит от белка mes-4: если его отключали, подкармливая самок интерферирующими РНК, то к восьмиклеточной стадии первоначальная асимметрия в метилировании гистонов родительских геномов полностью утрачивалась, в отцовском геноме также оказывались метилированные гистоны. Белок mes-4 — это один из регуляторов модификаций гистонов, но он, согласно имеющимся сведениям, отвечает за метилирование лизина в положении 36 гистона H3. В отличие от K27me3, метка K36me2/3 характерна для активно работающих генов.
Затем экспериментаторы анализировали экспрессию генов в клетках-предшественниках гамет при двух вариантах скрещиваний. Обнаружилось 149 генов с повышенной экспрессией и 116 генов с пониженной экспрессией в клетках у потомков K27me3 M+P− по сравнению с контрольными K27me3 M+P+. Использовав различия в генетических последовательностях, ученые попытались определить отцовскую либо материнскую принадлежность секвенированных молекул РНК для этих генов. Это удалось сделать для 34 генов с повышенной экспрессией и для 44 генов с пониженной экспрессией.
Оказалось, что большинство молекул РНК для генов с повышенной экспрессией происходят из генома отцов, а РНК-продукты генов с пониженной экспрессией в равной степени происходят из отцовского и материнского геномов. Это вполне логично. Повышенная экспрессия, вероятно, обусловлена отсутствием в отцовском геноме метки K27me3, обеспечивающей подавление активности генов в материнских хромосомах, а пониженная экспрессия скорее всего является опосредованной: например, она может быть связана с избыточным производством какого-то транскрипционного фактора, работающего в качестве репрессора для данных генов, — эти факторы могут в равной степени регулировать как отцовские, так и материнские гены.
Также было отмечено, что, хотя потомки F1 от обоих вариантов скрещивания были вполне фертильными, получаемое потомство F2 в случае использования K27me3 M+P− в скрещиваниях на 30% состояло из стерильных особей. Вероятно, из-за нарушения экспрессии генов в клетках-предшественниках гамет их свойства в некоторой степени нарушались. Действительно, гены с пониженной экспрессией как раз отвечают в основном за поддержание специфических свойств клеток зародышевой линии, а гены с повышенной экспрессией по большей части известны как регуляторы дифференцировки соматических клеток. И именно те особи, у которых в клетках-предшественниках гамет обнаруживался синтез белков соматических клеток (анализы проводили окрашиванием антителами) и производили на свет стерильное потомство.
Таким образом, в обсуждаемой работе показано, что, во-первых, состояние метилирования гистонов, переданных в зиготу с хромосомами отца, продолжает на протяжении жизни поддерживаться в клетках-предшественниках гамет у потомства, во-вторых — что это напрямую отражается на экспрессии генов в клетках-предшественниках гамет, и в-третьих — что это в конечном счете отражается на функциональности клеток и фертильности потомства. Всё это может быть важно для понимания того, как передаются признаки от родителей к потомству и у людей. Если только результаты, полученные на нематодах, не окажутся применимы исключительно к ним. Как минимум, это заслуживает будущей проверки.
Источник: Kiyomi Raye Kaneshiro, Andreas Rechtsteiner & Susan Strome. Sperm-inherited H3K27me3 impacts offspring transcription and development in C. elegans // Nature Communications. 2019. V. 10. Article number 1271. DOI: 10.1038/s41467-019-09141-w.
Татьяна Романовская, Эпигенетическое наследование через гистоны хромосом сперматозоидов доказано экспериментально // «Академия Тринитаризма», М.,
|
|