|
|
|
А.В. Косарев
АННОТАЦИЯ
В статье рассмотрены вопросы, связанные с представлениями о механическом аналоге температуры. Показано, что средняя кинетическая энергия поступательного движения частиц не может выступать в таком качестве. Однозначного механического аналога температуры не существует вообще. Решающее значение для установления равновесного состояния имеют соотношения модулей средних импульсов частиц и их масс.
Ключевые слова: Температура, тепло, термодинамическая система, равновесное состояние, параметр состояния, максвелловское распределение, импульс, энергия.
Температура - это то, что выравнивается в процессе установления равновесия в термодинамической системе, т.е. характеризует тепловое равновесие тел. Причём тела могут быть самой различной физической природы: твёрдые, жидкие, газообразные, одно и многокомпонентные, их может быть самое различное количество, они могут иметь разные объёмы и давления. Но когда между ними установится тепловое равновесие, они будут иметь одну и туже температуру. Как установлено из практики в процессе установления равновесия, от тел с большей температурой к телам с меньшей температурой передаётся энергия.
УСТОЯВШИЕСЯ ПРЕДСТАВЛЕНИЯ О МЕХАНИЧЕСКОМ АНАЛОГЕ ТЕМПЕРАТУРЫ
Анализ литературы показывает, что к настоящему времени наиболее устоявшимся и обще принятым является представление о температуре как мере нагретости тел, связанной с интенсивностью движения частиц системы. В качестве механического аналога температуры выступает статистически усреднённая кинетическая энергия поступательного движения хаотически движущихся молекул.
Из молекулярно-кинетических представлений о строении вещества давление газа понимается как передача импульса от хаотически движущихся молекул к стенкам сосуда. При этом для идеального газа по формуле Бернулли имеем:
![]() (1)
(1)
где: P- давление газа на стенки сосуда, n- концентрация частиц газа, ![]() - средняя поступательная скорость хаотически движущихся молекул газа,
- средняя поступательная скорость хаотически движущихся молекул газа, ![]() - средний импульс хаотически движущихся молекул, передаваемый стенке молекулой при соударении.
- средний импульс хаотически движущихся молекул, передаваемый стенке молекулой при соударении.
Согласно закона Авогадро, вытекающего из закона кратных соотношений, при одинаковых давлениях и температурах в равных объёмах содержится одинаковое число молекул.
Имеем два газа 1 и 2. Причём P1=P2 и T1=T2 (2)
Учитывая равенство давлений и (1) запишем:
![]() (3)
(3)
Учитывая (2) и закона Авогадро (n1 = n2) , после сокращения получаем:
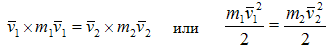
Отсюда принимается, что при равенстве температур средние кинетические энергии молекул различных газов равны между собой. А с учётом того, как уже отмечалось ранее, что в процессе установления равновесия от тел с большей температурой к телам с меньшей температурой передаётся энергия и принято считать, что величиной играющей в газе роль температуры является средняя кинетическая энергия хаотического поступательного движения молекул. Передача энергии от горячего газа к холодному происходит до тех пор, пока средние кинетические энергии молекул двух газов не сравняются, и не наступит равновесное состояние, при котором между совокупностями частиц разных газов происходит обмен равными совокупными энергиями и динамическое равновесие сохраняется. Таковы представления на сегодняшний день о механическом аналоге температуры, в качестве которого принято считать среднюю кинетическую энергию хаотического движения. ![]() (4). Все молекулы равновесной термодинамической системы, независимо от их сорта или агрегатного состояния, в данной системе имеют одинаковую среднюю кинетическую энергию, и энергия при столкновениях уже не передаётся от частиц одного сорта к частицам другого. Главным доказательством данного воззрения является закон Авогадро. Согласно этому закону моли различных газов при одинаковых давлениях и температуре занимают одинаковые объёмы. То есть концентрации частиц различных газов при одинаковых давлениях и температуре равны. С учётом этого из основного уравнения молекулярно-кинетической теории, связывающего давление газа с его концентрацией и средней хаотической скоростью частиц, и получают вывод о температуре как средней кинетической энергии частиц, как показано выше. В свою очередь доказательством закона Авогадро служит экспериментально установленный закон кратных соотношений. Он гласит, что объёмы участвующих в химических реакциях газов соотносятся как стехиометрические коэффициенты химических уравнений. Предпринимались попытки теоретически вывести данное представление о температуре, исходя из законов динамики и столкновения частиц. Так автор [24] посвятил этому большой параграф, однако доказательство не выглядит убедительным. Видимо, учитывая этот опыт, авторы [20] вынесли данный вопрос в виде короткого решения задачи в разделе упражнения. При этом они отказались от динамического решения задачи, а сделали упор на статистику, но и здесь получилось не убедительно.
(4). Все молекулы равновесной термодинамической системы, независимо от их сорта или агрегатного состояния, в данной системе имеют одинаковую среднюю кинетическую энергию, и энергия при столкновениях уже не передаётся от частиц одного сорта к частицам другого. Главным доказательством данного воззрения является закон Авогадро. Согласно этому закону моли различных газов при одинаковых давлениях и температуре занимают одинаковые объёмы. То есть концентрации частиц различных газов при одинаковых давлениях и температуре равны. С учётом этого из основного уравнения молекулярно-кинетической теории, связывающего давление газа с его концентрацией и средней хаотической скоростью частиц, и получают вывод о температуре как средней кинетической энергии частиц, как показано выше. В свою очередь доказательством закона Авогадро служит экспериментально установленный закон кратных соотношений. Он гласит, что объёмы участвующих в химических реакциях газов соотносятся как стехиометрические коэффициенты химических уравнений. Предпринимались попытки теоретически вывести данное представление о температуре, исходя из законов динамики и столкновения частиц. Так автор [24] посвятил этому большой параграф, однако доказательство не выглядит убедительным. Видимо, учитывая этот опыт, авторы [20] вынесли данный вопрос в виде короткого решения задачи в разделе упражнения. При этом они отказались от динамического решения задачи, а сделали упор на статистику, но и здесь получилось не убедительно.
Полный текст доступен в формате PDF (539Кб)
А.В. Косарев, Импульсная составляющая в трактовке температуры // «Академия Тринитаризма», М.,
|
|